|
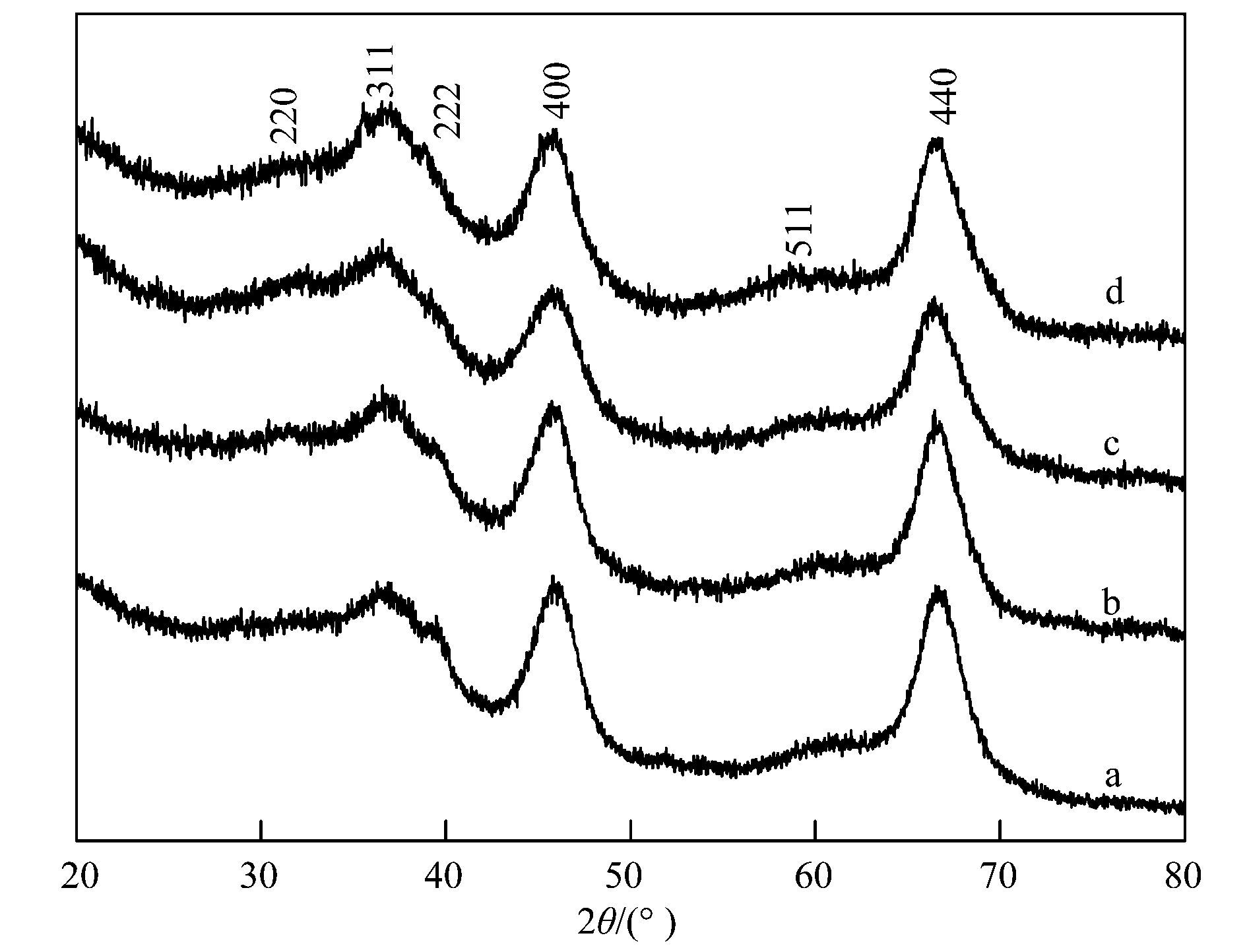
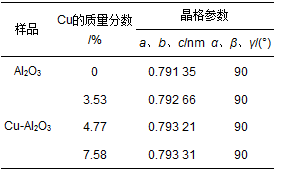
工业废水及饮用水中有机污染物催化去除机制作为高级催化氧化技术的一种,芬顿氧化法由于能够快速产生高浓度的羟基自由基(·OH),通常作为生物氧化的前处理或后处理单元技术应用于难降解工业废水处理和饮用水深度净化.均相芬顿反应虽然催化效率较高,但进出水不仅需要大量的酸碱调节pH,而且处理过程中产生大量的铁泥,不仅造成二次污染,还使废水处理成本大幅度提高.而非均相芬顿反应由于可以克服这些缺点而逐渐引起研究者的广泛关注.非均相芬顿催化反应的关键是高效稳定催化剂的研发.目前国内外所研制的非均相芬顿催化剂多是含铁的固相催化剂,如铁氧化物和金属复合氧化物、铁离子或铁氧化物负载于分子筛、黏土、碳材料等.这些非均相芬顿催化剂在pH 4~5的条件下,实现了Fe (Ⅱ)/Fe (Ⅲ) 循环,减少了污泥的产生,提高了催化效率.但是在pH>6,水体通常酸碱条件下,Fe (Ⅲ) 难以被H2O2还原为Fe (Ⅱ),其速率常数仅为0.001~0.02 L·(mol·s)-1,限制了芬顿反应速率,通常需要光、电、超声等外能辅助.根据已有报道,Cu+可以催化H2O2分解产生羟基自由基(·OH),其反应速率常数为4.1×103 L·(mol·s)-1比Fe2+与H2O2反应的速率常数76 L·(mol·s)-1高将近2个数量级,而且Cu2+可以与H2O2作用转化为Cu+,其反应速率常数为460 L·(mol·s)-1,远远高于Fe3+还原返回到Fe2+的速率常数,所以Cu+/Cu2+较容易循环.但是,Cu+在水中的不稳定性限制了其应用. Cu+和Cu2+的固定化是铜基芬顿催化剂应用的关键.国内外对铜基多相芬顿催化剂的研发已经取得了一些进展,主要包括两种类型:一类是复合氧化物,如CuFeO2、Cu掺杂αFeOOH、CuFe2O4等.另一类是铜离子或铜氧化物负载于金属氧化物、分子筛(如Y和SBA-15)、黏土、活性炭等.目前所报道的这些含铜类芬顿催化剂的结构中铜主要以Cu2+离子或者氧化铜的形式存在,虽然实现了在近中性温和条件下进行催化反应,但是仍然存在铜离子溶出严重、H2O2无效分解产生氧气的问题,导致催化效率低,H2O2消耗量过大.有研究发现Cu+和Cu2+可以稳定地共存于LaTiO3结构中,在pH 4~9的范围内对罗丹明B的脱色均显示出较高的芬顿催化效率.其原因之一是催化剂结构中Cu+和Cu2+在常温条件下易于发生循环反应,加速界面电子转移,从而提高了芬顿反应效率和催化剂稳定性.本文针对水中难降解有机污染物的去除问题,以酚类化合物2-氯苯酚(2-chlorophenol,2-CP) 和染料罗丹明B (Rhodamine B,RhB) 为模型污染物,通过简单的共沉淀法将Cu2+和Cu+共同掺入Al2O3的骨架结构中,得到高活性高稳定性的非均相类芬顿催化剂,系统地研究了其结构特征和催化特性,并提出了其催化反应机制. 1 材料与方法 1.1 实验材料及试剂 三水硝酸铜,九水硝酸铝,氨水(25%),2-氯苯酚(2-CP),过氧化氢(H2O2,质量分数30%) 均购自国药集团化学试剂有限公司;5-叔丁羧基-5-甲基-1-吡咯啉-N-氧化物(5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide,BMPO) 来自于Sigma Aldrich公司;所有化学试剂至少是分析纯. 1.2 催化剂的制备 Cu-Al2O3的制备如下:准确称取1.88 g九水硝酸铝和0.12 g三水硝酸铜,溶于去离子水.逐滴加入氨水(25%),调pH至9.0,80℃水浴搅拌过夜,然后离心,水洗3次,干燥,得到的材料在500℃空气条件下煅烧4 h,得到绿色的Cu-Al2O3样品.此外,利用硝酸和氢氟酸溶解材料,然后通过电感耦合等离子体发射光谱仪(ICP-OES,OPTIMA 2000 Perkin Elmer Co.) 测定材料中铜的含量,计算得到此制备过程所得催化剂中铜的质量分数约为4.77%.通过改变铜盐的投加量,可制备得到不同Cu掺杂量的Cu-Al2O3.为了对比,在不加铜盐的情况下,制备得到纯Al2O3. 1.3 催化剂的表征 采用Scintag-XDS-2000型X射线衍射仪测定了催化剂的晶体结构;采用英国Kratos公司AXIS Ultra X射线光电子能谱(XPS) 对Cu-Al2O3表面各元素形态及含量进行分析;Cu的K边(8.979 keV) 扩展X射线吸收精细结构(EXAFS) 谱图采用上海光源同步辐射装置(SSRF) 在室温光束传输模式(BL14W1) 下测定;采用Hitachi U-3900型紫外-可见分光光度计测定固体催化剂的紫外可见漫反射吸收光谱. 1.4 催化剂类芬顿催化降解有机污染物 以2-CP和RhB为目标物考察所制备样品的类芬顿催化性能. ①对2-CP的降解:室温下将0.07 g催化剂加入到50 mL浓度为10 mg·L-1的2-CP溶液中,于暗处搅拌20 min,使其达到吸附平衡.然后加入20 mmol·L-1 H2O2,进行类芬顿催化降解.溶液初始pH=6.5,由于整个反应过程中pH基本不发生变化,因此反应过程中不调节溶液pH.每隔固定时间取样,经0.45 μm的滤膜过滤,然后用高效液相色谱仪(1 200 series;Agilent) 测定2-CP的浓度.测定条件为: Zorbax SB-Aq柱(5 μm,4.6×250 mm;Agilent),检测波长为275 nm;流动相为甲醇:水(60:40),进样量为20 μL,流速为1.0 mL·min-1. ②对RhB的降解:室温下将0.025 g催化剂加入到50 mL浓度为5 mg·L-1的RhB溶液中,暗吸附20 min后,加入10 mmol·L-1 H2O2,进行类芬顿催化降解,反应过程中不调节溶液pH.每隔固定时间取样,离心后立即用紫外可见光谱仪(Hitachi U3900) 在最大吸收波长处测定其浓度.总有机碳(TOC) 用TOC-VCPH(Shimadzu) 总有机碳分析仪测定.使用电感耦合等离子体发射光谱仪(ICP-OES,OPTIMA 2000 Perkin Elmer Co.) 分析反应过程中溶液里金属离子的浓度. 2 结果与讨论 2.1 催化剂的表征 通过简单的共沉淀法制备得到一系列铜掺杂铝氧化物催化剂,图 1为不同样品的X射线衍射(XRD) 图谱.不同铜含量的催化剂样品Cu-Al2O3 (Cu所占质量分数:3.53%、4.77%、7.58%) 的衍射峰与未掺杂铝氧化物具有相同的晶型结构,根据X射线衍射标准谱图对比可知,所制备样品Al2O3和不同铜含量的Al2O3均显示γ-Al2O3(JCPDS 29-0063) 晶相的(220)、(311)、(222)、(400)、(511) 和(440) 的特征衍射峰,且没有含铜或铜氧化物杂峰的出现,这可能由于铜物种在Al2O3表面分散性良好、以无定形形态存在或者取代Al进入Al2O3结构中.此外,如表 1所示,随着Al2O3中铜的质量分数增加到4.77%,样品的晶格参数明显地增加,而当铜的质量分数进一步增加到7.58%时,晶格参数仅略微增加.由于Cu2+或Cu+的离子半径均比Al3+大,以上晶格参数的明显增加说明Cu取代Al进入Al2O3的晶格中,暗示Al-O-Cu键在Cu-Al2O3中的形成.而晶格参数的略微增加说明铜含量高于4.77%的部分几乎没有取代Al进入晶格结构中.
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 图 1 不同催化剂的XRD谱图
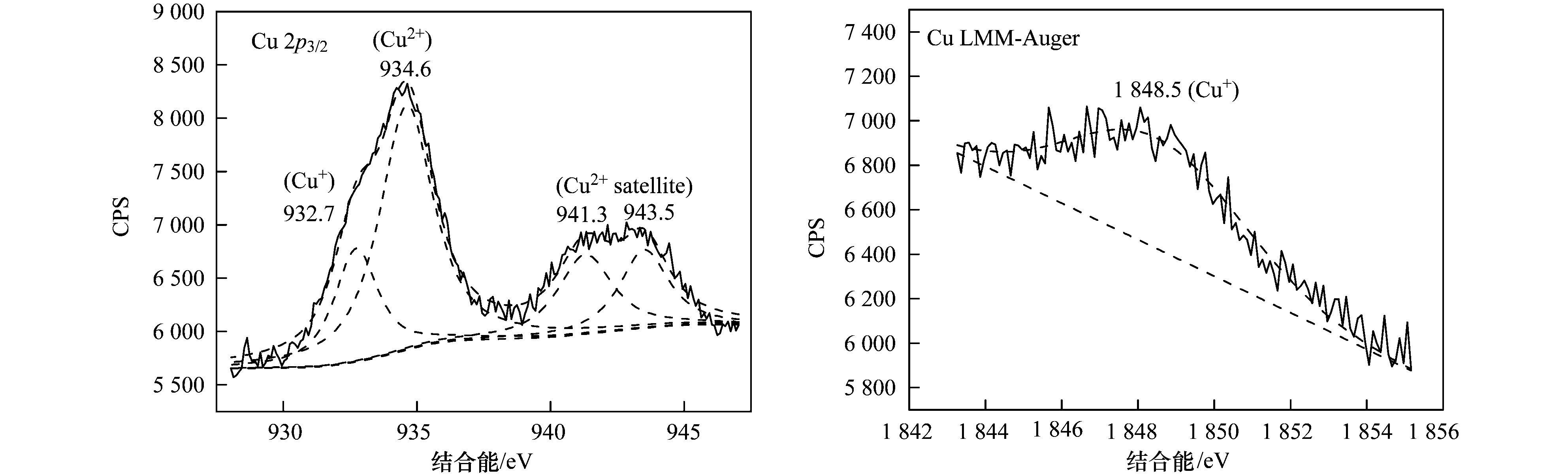
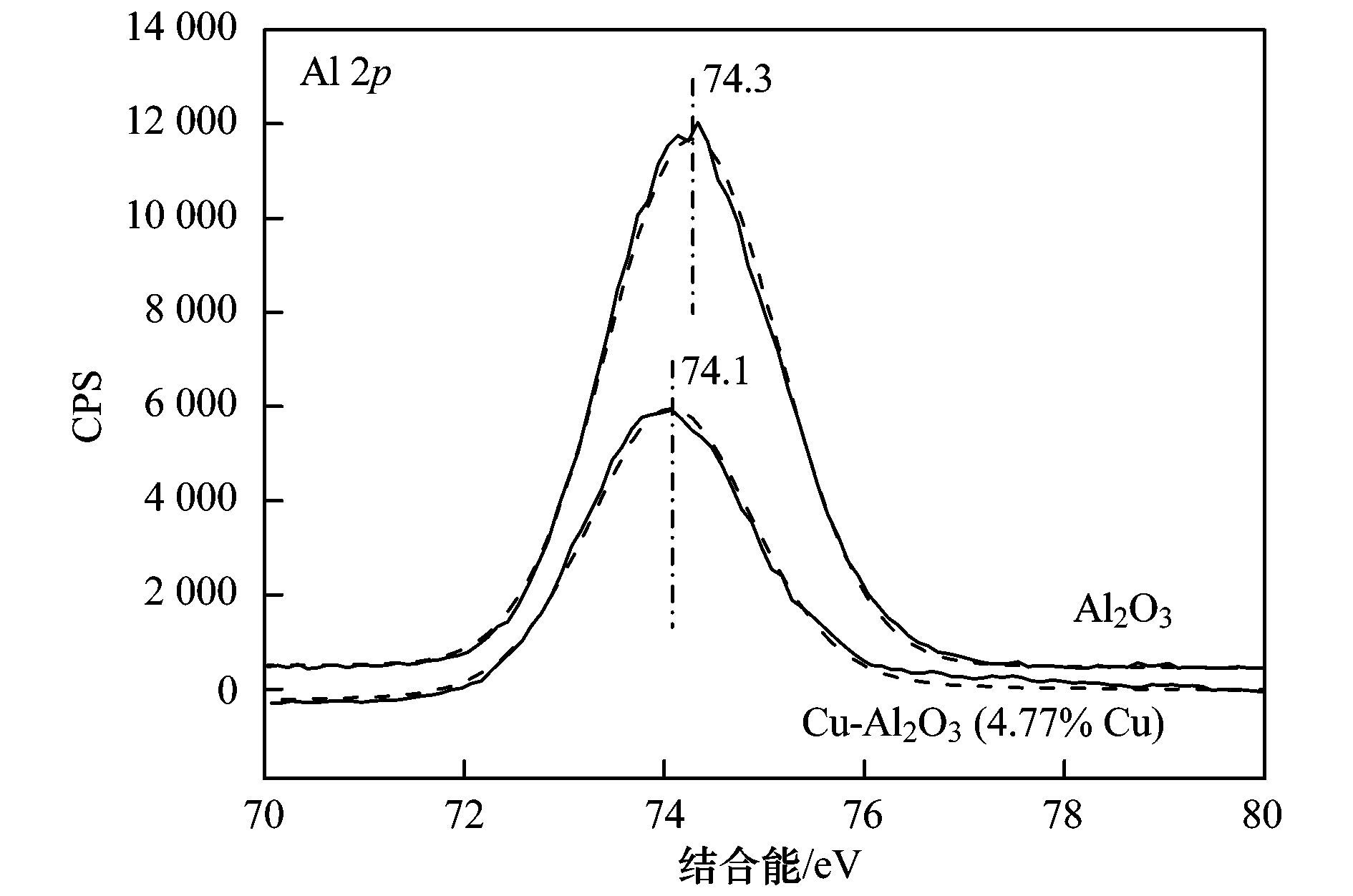
表 1 不同样品的晶格参数 进一步通过XPS分析了Cu-Al2O3表面元素形态,见图 2. Cu-Al2O3 (4.77% Cu) 的Cu 2p3/2光电子能谱可以利用XPS分峰软件进行拟合分峰,由分峰谱可以看出,该催化剂表面存在Cu2+(934.6 eV) 和低价Cu (932.7 eV). Cu2+也可以由941.3~943.5 eV范围的伴峰来确定.由于低价Cu物种(即Cu0或Cu+) 的结合能很相近,因此它们难以由单一的XPS数据来确定,而需要由俄歇参数来分辨还原性Cu物种.通过俄歇电子能谱(AES) 进行进一步的测定,俄歇参数为1 848.5 eV证实Cu+的存在.催化剂表面Cu2+和Cu+的原子比约为2.64:1.此外,根据XPS分析结果,表面Cu/Al原子比为1/19.5,略高于体相Cu/Al原子比(1/24.1),这说明Cu-Al2O3 (4.77% Cu) 中铜比较均匀地分散于体相中,即Cu很可能部分取代Al进入Al2O3晶格中.如图 3所示,进一步从Al2O3的Al 2p XPS谱图中可以看出,Al 2p的结合能为74.3 eV,归属于Al-O-Al中Al3+的特征峰;当Cu引入Al2O3后,Al 2p的结合能降低为74.1 eV,说明Al周围的键合环境发生了变化,预示Al-O-Cu键的形成.不同样品中Cu的K边傅里叶变换EXAFS信号图如图 4所示. Cu-Al2O3 (4.77% Cu) 样品中出现了两个壳层,其中一个壳层在0.144 nm附近,归属于Cu-O壳层.另一个壳层位于0.268 nm,比CuO (0.244 nm) 和Cu2O (0.255 nm) 中的Cu-Cu壳层都长,说明该壳层归属于Cu-Al壳层,即Cu-Al2O3 (4.77% Cu) 中形成了Al-O-Cu键.
图 2 Cu-Al2O3 (4.77% Cu) 表面Cu的XPS谱图
图 3 Al2O3和Cu-Al2O3 (4.77% Cu) 表面Al的XPS谱图
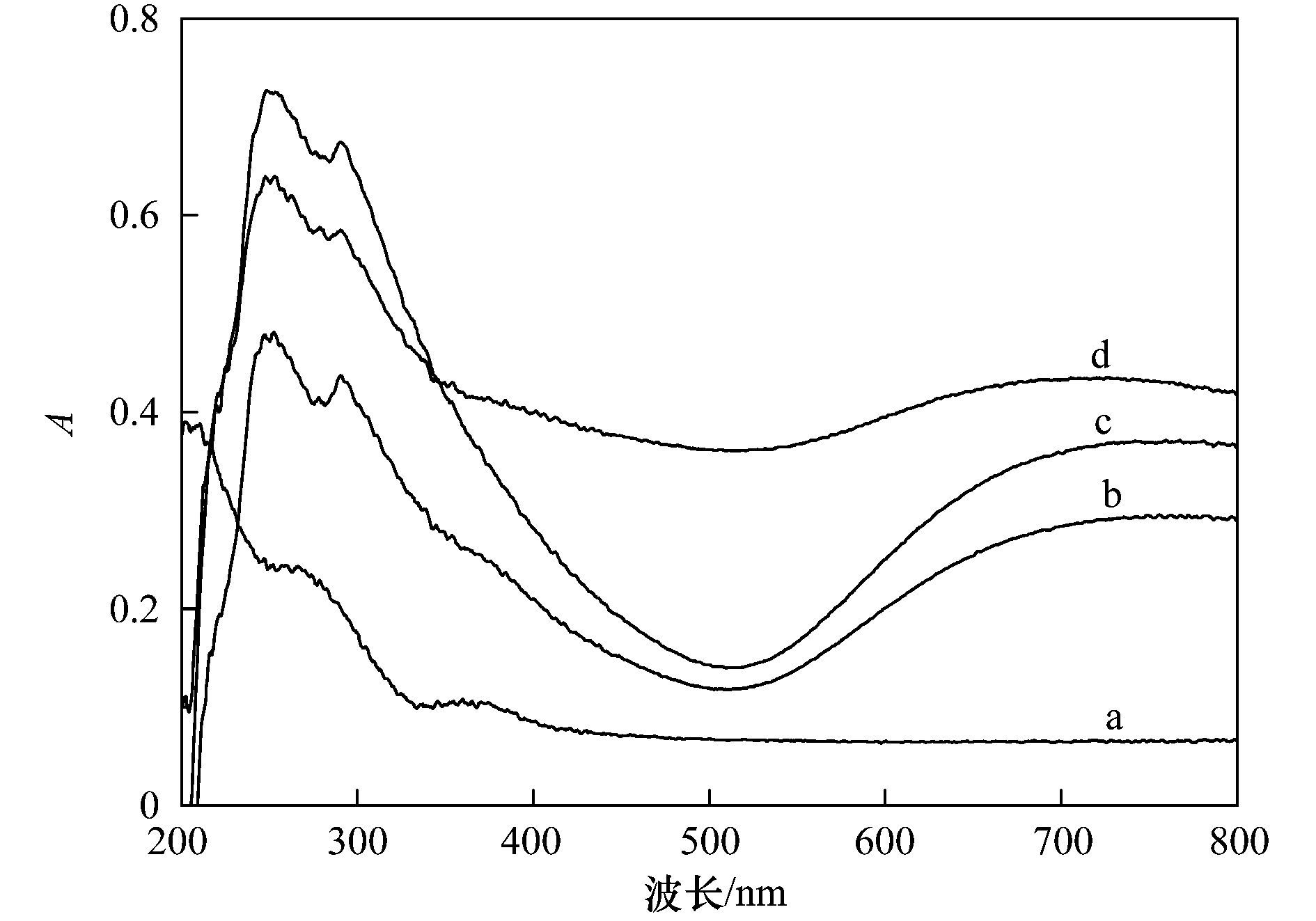
图 4 不同样品的Cu K边EXAFS傅里叶变换谱图 另外,铜在Cu-Al2O3中的形态通过UV-vis DRS进一步地测定(图 5).与未掺杂的Al2O3相比,Cu-Al2O3在750 nm左右出现一个明显的吸收带,这是Cu2+在尖晶石晶格八面体位点的电子转换产生的,说明铜掺杂进入了Al2O3晶格,进一步说明了Al-O-Cu键的形成.此外,Cu-Al2O3 (7.58% Cu) 在520 nm左右的紫外可见吸收明显增加,这是外骨架铜聚物或者铜氧化物团簇存在导致的,说明过量的Cu掺杂致使催化剂中外骨架铜氧化物的存在.
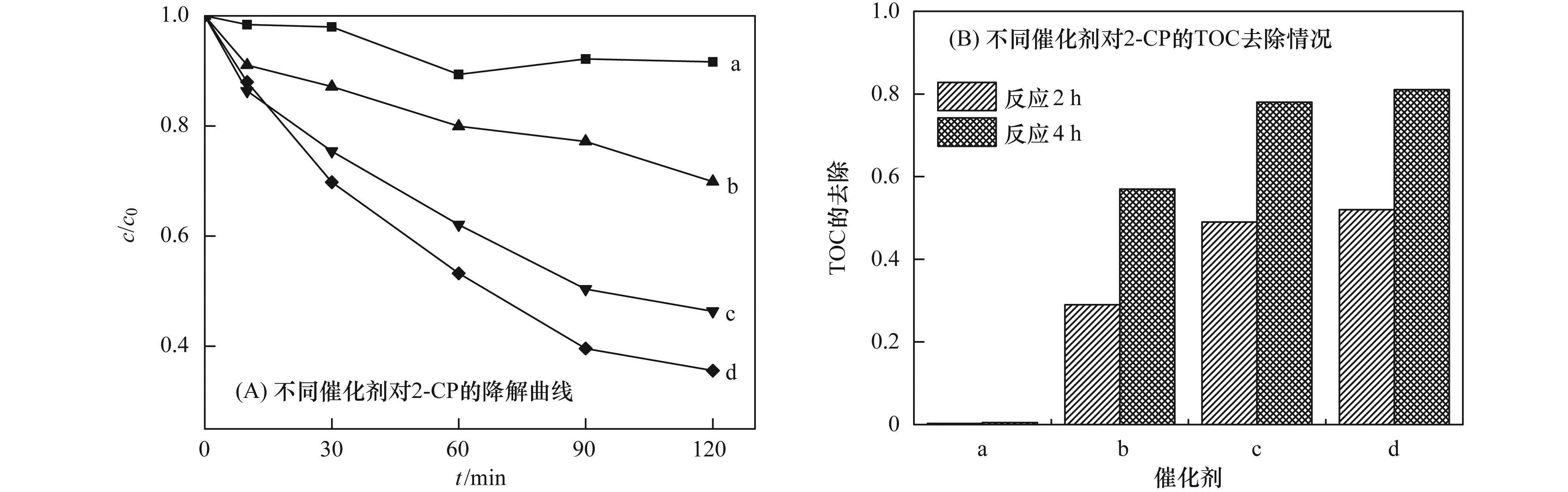
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 图 5 不同催化剂的UV-vis DRS谱图 2.2 Cu-Al2O3类芬顿催化降解有机污染物的活性及稳定性 催化剂的催化活性和稳定性是评价催化剂催化性能的两个主要因素. 图 6显示了不同催化剂对2-CP的催化降解和矿化情况.从中可以看出,在H2O2存在下,未掺杂的Al2O3对2-CP几乎无降解作用.随着Cu掺杂量的增加,催化剂的催化活性呈现逐渐增加的趋势,催化反应120 min,对2-CP底物的去除率由Cu-Al2O3 (3.53% Cu) 的30%提高到Cu-Al2O3 (4.77% Cu) 的54%,而继续增加Cu的掺杂量,催化活性的增加变缓,Cu-Al2O3 (7.58% Cu) 对2-CP底物的去除率约为64%. Cu掺杂量对催化剂矿化活性的影响呈现同样的趋势,反应2 h,Cu-Al2O3 (3.53%,4.77%,7.58% Cu) 对2-CP的TOC去除率分别为29%、49%和52%,进一步反应4 h,TOC去除率可分别达到57%、78%和81%.对比反应2 h内2-CP底物和TOC的去除率,可以看出Cu-Al2O3 (3.53%,4.77% Cu) 几乎能够同步去除2-CP底物和TOC,说明骨架铜物种对2-CP具有显著地矿化效果,而Cu-Al2O3 (7.58% Cu) 中外骨架铜物种的存在对2-CP底物去除具有一定的效果,而对TOC的去除效果不显著.
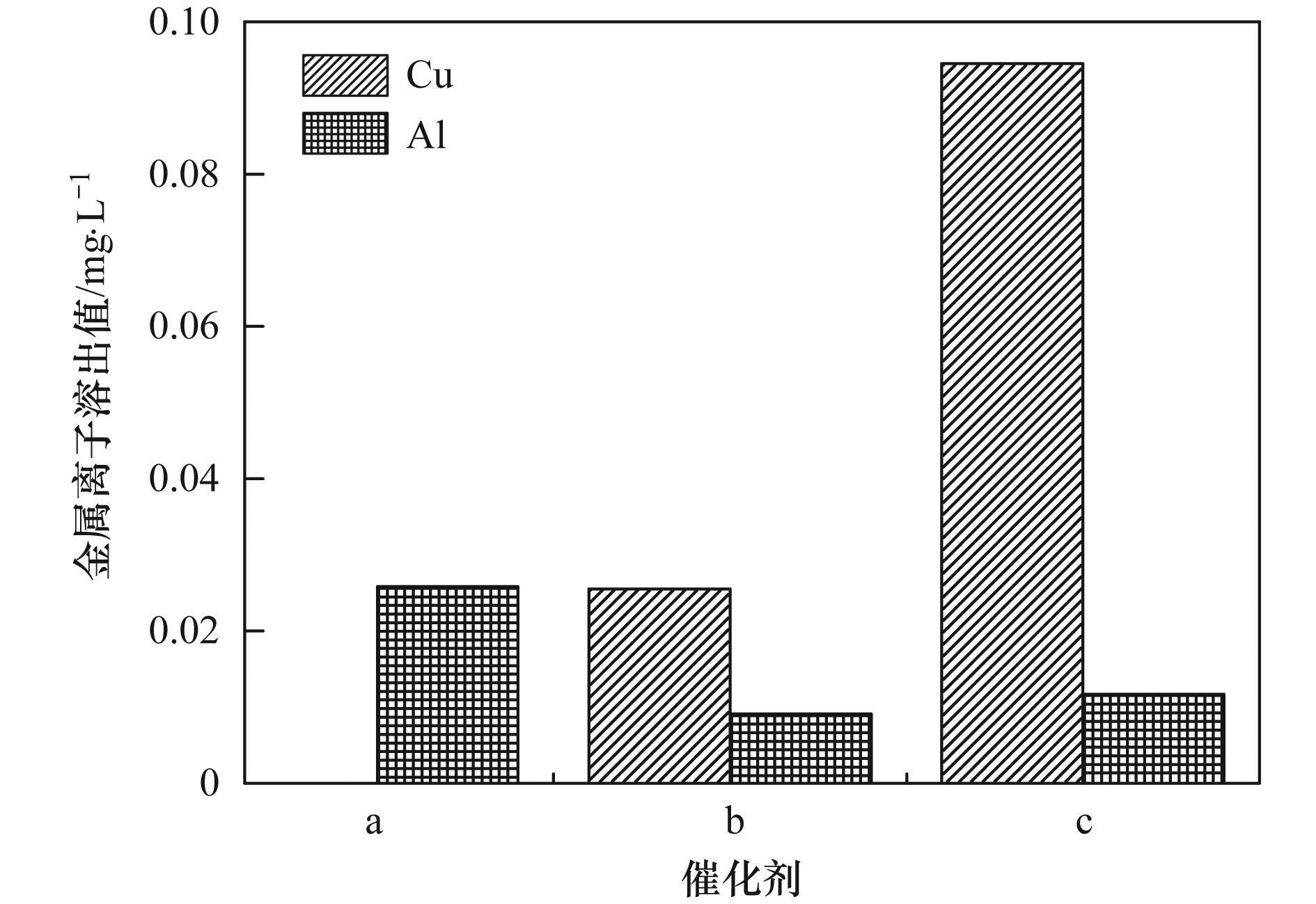
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 图 6 Cu掺杂量对催化剂类芬顿催化降解和矿化2-CP的影响 反应过程中金属离子的溶出是评价催化剂稳定性的一个重要因素. 图 7考察了不同催化剂Cu-Al2O3 (3.53%、4.77%、7.58% Cu) 催化降解2-CP反应2 h后的金属溶出情况.从中可知,在反应过程中不同催化剂的铝溶出量很少,可以忽略不计.而随着催化剂中Cu掺杂量的增加,催化剂的铜溶出量逐渐增加,Cu-Al2O3 (3.53% Cu) 在反应过程中没有检测到铜离子溶出,反应2 h后,Cu-Al2O3 (4.77% Cu) 的反应溶液中铜离子浓度约为0.0255 mg·L-1,而Cu-Al2O3 (7.58% Cu) 体系中铜离子溶出量约为0.0945 mg·L-1.
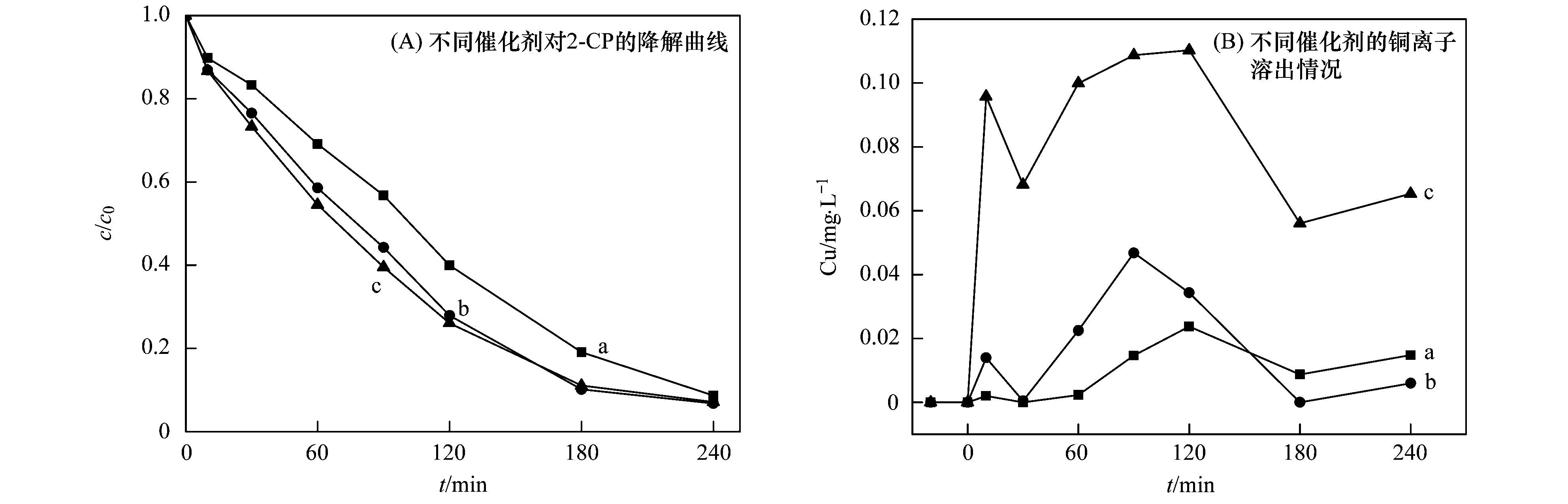
a. Cu-Al2O3 (3.53% Cu);b. Cu-Al2O3 (4.77% Cu);c. Cu-Al2O3 (7.58% Cu) 图 7 Cu掺杂量对催化剂稳定性的影响 类似地,不同催化剂Cu-Al2O3 (3.53%、4.77%、7.58% Cu) 催化降解水中染料RhB的实验也证明相比Cu-Al2O3 (3.53%和7.58% Cu),Cu-Al2O3 (4.77% Cu) 具有较高的催化活性和较低的铜离子溶出(见图 8).由此可以确定Cu的最佳掺杂量为4.77%. Cu-Al2O3催化剂的结构表征已经表明Cu-Al2O3 (3.53%,4.77% Cu) 中Cu主要以骨架铜的形式存在,而过量的Cu掺杂,如Cu-Al2O3 (7.58% Cu),将导致外骨架铜物种的存在,这也是催化活性增加减慢和稳定性下降的主要原因.
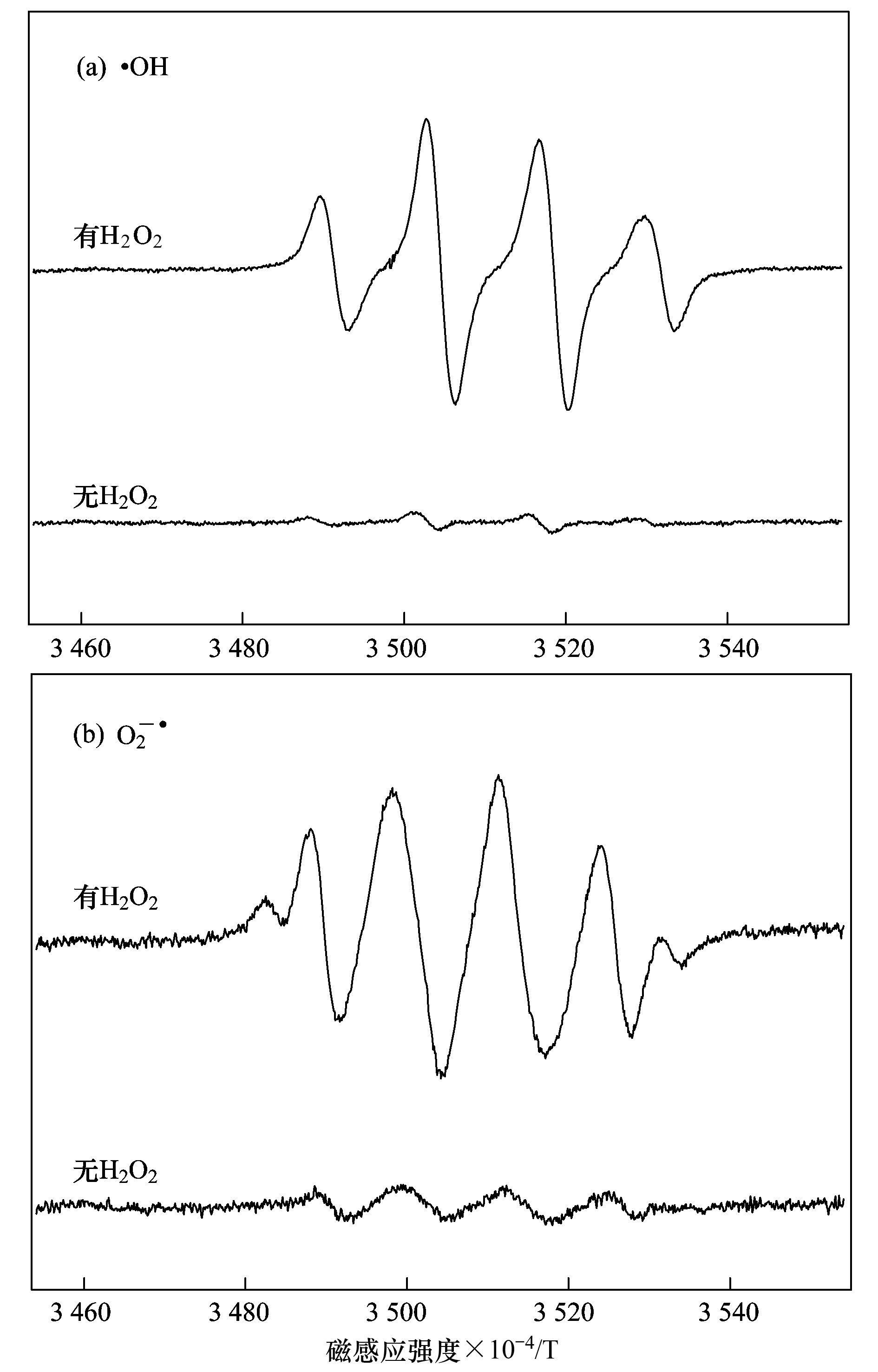
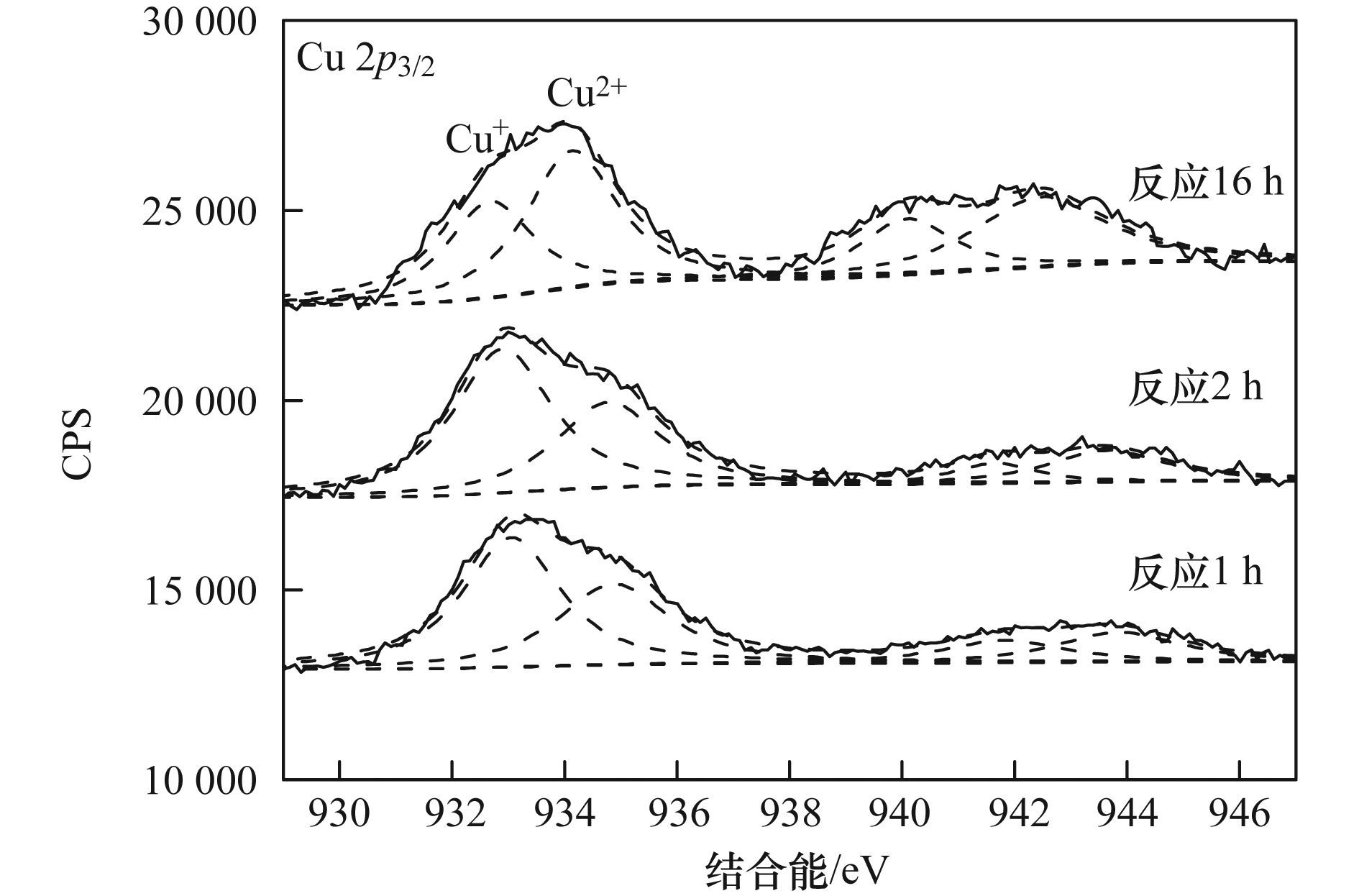
a. Cu-Al2O3 (3.53% Cu);b. Cu-Al2O3 (4.77% Cu);c. Cu-Al2O3 (7.58% Cu) 图 8 Cu掺杂量对催化剂类芬顿催化降解RhB活性和稳定性的影响 2.3 Cu-Al2O3的类芬顿催化机制 ESR是测定短寿命自由基的一种非常有效的现代分析技术,其测定信号有助于理解芬顿催化反应机理.本实验中使用不饱和的抗磁性物质BMPO自旋捕捉剂与自由基生成寿命较长的自旋加合物而间接进行自由基的测定.如图 9所示,在没有加入H2O2的条件下,几乎没有自由基特征信号峰的生成,加入H2O2,在水体系中,出现典型的BMPO-·OH加合物信号1:2:2:1的四重峰. HO2-/O2-·在水溶液中不稳定[20],所以在甲醇体系中进行HO2·的ESR测定.由图 9中可以看出,H2O2存在体系的ESR波谱中检测到BMPO-HO2-/O2-·加合物的特征峰.活性氧物种的测定结果表明催化剂Cu-Al2O3 (4.77% Cu) 将H2O2分解成高活性的·OH和HO2-/O2-·自由基.此外,根据XPS分析(图 10),反应1、2 h和16 h后,Cu-Al2O3 (4.77% Cu) 表面Cu2+和Cu+的原子比分别为0.71:1、0.62:1和1.47:1,相比反应前催化剂表面Cu2+和Cu+的原子比2.64:1,可以看出反应过程中Cu2+迅速地还原为Cu+,最终Cu+又转化回Cu2+,此外,根据催化剂的表征结果,Cu2+和Cu+在Al2O3骨架结构中共存,而且催化反应后催化剂的铜离子溶出量非常低,说明催化剂在与H2O2相互作用的过程中,骨架铜物种Cu2+和Cu+能够快速地发生循环反应,加速电子转移,从而获得较高的芬顿催化效率和稳定性.
图 9 Cu-Al2O3 (4.77% Cu)/H2O2体系中·OH和HO2-/O2-·的生成情况
图 10 反应后Cu-Al2O3 (4.77% Cu) 表面Cu的XPS谱图 3 结论 (1) 通过简单的共沉淀法制备了Cu掺杂的Al2O3类芬顿催化剂.结构表征结果表明铜主要以Cu2+和Cu+的形式共存于Al2O3的骨架结构中. (2) 铜的掺杂提高了催化剂类芬顿催化降解活性,其最佳掺杂量为4.77%;Cu-Al2O3中骨架铜的存在是提高催化活性和催化稳定性的主要原因. (3) Cu-Al2O3类芬顿催化反应体系中,催化剂与H2O2相互作用,骨架铜物种Cu2+和Cu+能够快速地发生循环反应,催化H2O2产生·OH和HO2-/O2-·. |